如何快速区分共价键和离子键?
2025-04-26
大多数金属元素与非金属元素之间形成离子键,而非金属元素之间则形成共价键。基于这个原理,也可以通过电负性的差异来粗略地判断键的性质。
为什么可以用电负性来确定共价键?电负性是指原子在化学键中吸引电子的能力。电负性的差异描述了化学键的类型,因为电子之间吸引力的相对强度决定了键的类型。吸引力越强,被吸引向该原子的电子就越多,从而使该原子部分带负电,而另一个原子则部分带正电。
这是一个经验标准:
- ️电负性差 > 1.7:该键表现出️离子键特性。这可以理解为吸引电子能力的显著差异,其中一个原子完全获得电子,而另一个原子则完全失去电子(一侧“完全获得”,另一侧“完全失去”)。
- ️0.4 < 电负性差 < 1.7:该键表现出️极性共价键的特征。这意味着两者的电子吸引能力存在差异,但不足以实现完全的电子转移。相反,电子更倾向于吸引较强的原子,但无法完全转移(即“竞争性斗争”)。
- ️电负性差异 < 0.4:该键表现出️非极性共价键的特性。电子吸引能力的差异可以忽略不计,这意味着电子不会被明显地吸引到一侧(“平衡的战斗”)。
按照这个标准,我们就可以理解为什么像H₂和O₂这样的双原子分子会形成非极性共价键,而氟和大多数金属则会形成离子键。对于电负性差接近1.7的分子,其化学键同时表现出共价键和离子键的特性。
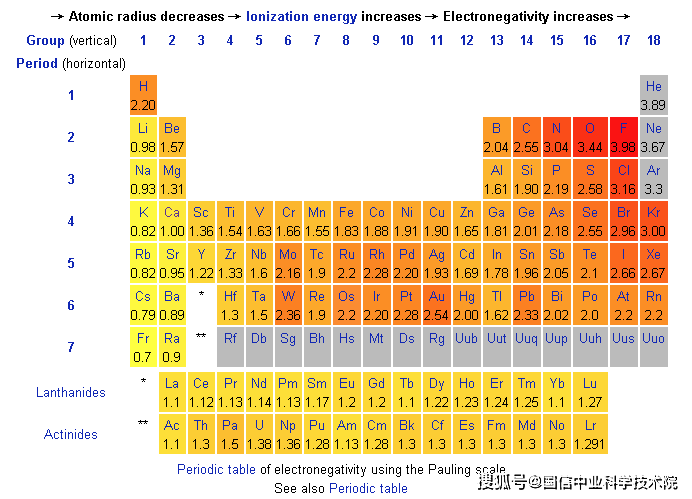 图1:电负性周期表
图1:电负性周期表


