华大DNBelab C系列 |单核RNA测序联合空间转录组学揭示脂多糖致脓毒症脑病小鼠模型胶质细胞和血管细胞特殊亚群


️期刊:Journal of neuroinflammation
️影响因子:9.3
️主要技术:snRNA-seq、Stereo-seq
️导语
脓毒症相关脑病(SAE)是脓毒症致死性并发症,约70%患者出现神经功能障碍,其机制涉及氧化应激及免疫失调,但病理机制尚未完全阐明。单核RNA测序(snRNA-seq)和空间转录组学(ST)技术的结合为解析复杂细胞异质性及空间分布提供了新工具。本研究以内毒素诱导的脓毒症模型小鼠为样本,整合snRNA-seq与Stereo-seq空间转录组技术,系统绘制了大脑中免疫细胞与血管相关细胞的动态转录Fig 谱。研究发现,关键蛋白Annexin A1(ANXA1)在SAE中显著上调,通过调控神经炎症及血脑屏障功能参与疾病进程。此外,研究鉴定了胶质细胞与血管细胞间促进免疫细胞迁移的关键配体-受体对,揭示了细胞互作网络在SAE中的核心作用。
️主要技术
展开全文snRNA-seq、Stereo-seq
️主要结果
️1. snRNA-seq分析揭示脓毒症模型小鼠大脑细胞亚群和基因表达特征
研究人员对LPS诱导的脓毒症模型的野生型(wild type)和Anxa1基因敲除(Anxa1−/−)小鼠共16个样本进行单细胞核RNA测序(snRNA-seq)。通过质控获得376,909个合格的细胞核,降维可视化后的数据识别出九个群,通过marker基因注释获得六种不同的细胞类型(Fig 1A-C)。两种小鼠的细胞类型组成没有显著差异,表明Anxa1并不影响参与大脑炎症反应的细胞组成(Fig 1D)。然而,Astro-2和Micro-2亚群体在刺激后在12小时Astro-2和Micro-2细胞比例均增加,在24小时时下降,并在72小时时恢复到基线水平(Fig 1E-G)。研究人员比较Astro-2与Astro-1细胞之间以及Micro-2与Micro-1细胞之间的差异表达基因(DEGs),Astro-2和Micro-2中上调的基因主要富集在与病毒反应、生物刺激调节和先天免疫反应相关的通路中(Fig 1H)。研究人员还关注了少突胶质细胞的转录组变化,发现Serpina3n和Cdkn1a等基因与疾病有关联(Fig 1I)。这些发现表明,在LPS刺激后的24小时内,Astro-2、Micro-2和Cdkn1a+Serpina3n+ OligoD细胞的比例显著增加,强调了它们在脓毒症症初始阶段的关键作用。
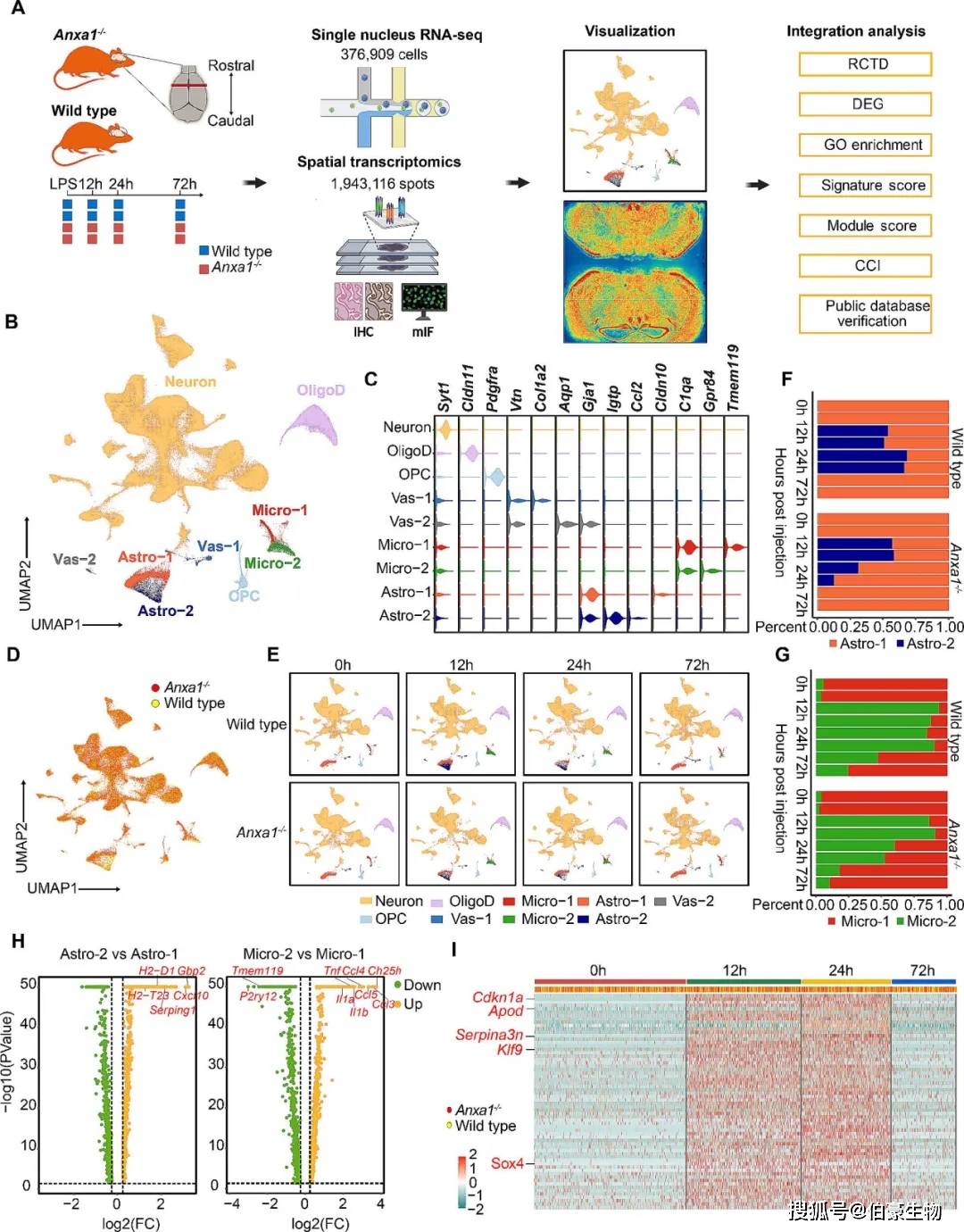 图 1 LPS刺激后小鼠大脑单细胞图谱
图 1 LPS刺激后小鼠大脑单细胞图谱
️2. 空间转录组测序揭示脓毒症模型小鼠大脑细胞组成及基因表达的动态变化
对相同的样本进行空间转录组测序(Stereo-seq),H&E染色显示第三脑室周围存在大量的室管膜细胞,并与空间转录组注释结果一致;Stereo-seq数据分析显示神经元的分布最为广泛(Fig 2A);两组样本之间并无显著差异,神经元占比最高,其次是胶质细胞,血管细胞数量最少(Fig 2B)。对不同时期的细胞占比进行统计发现,LPS刺激后12小时,两组的Astro-2和Micro-2亚型比例显著上调;24小时时,Micro-2比例在两组中仍显著升高,而Astro-2在wild type小鼠中保持上调,但在Anxa1−/−小鼠中恢复到基线水平;72小时时,Astro-2和Micro-2比例均恢复到基线水平(Fig 2C-D);通过空间可视化分析,进一步验证了细胞比例变化模式(Fig 2E-F);将snRNA-seq数据中发现的Cdkn1a+Serpina3n+ OligoD细胞的基因集在Stereo-seq数据中计算得分,阈值大于0.4识别为Cdkn1a+Serpina3n+ OligoD,其在24小时内显著增加,约占总少突胶质细胞的50%,这一结果与snRNA-seq分析一致(Fig 2G-H)。对这些细胞进GO富集分析显示,主要与“病毒反应”、“神经元死亡的调控”和“对病毒的防御反应”等通路相关,这些通路在LPS刺激后24小时尤为显著。Astro-2和Micro-2亚型还涉及“中性粒细胞趋化”和“髓样白细胞迁移”等炎症反应相关通路(Fig 2I)。
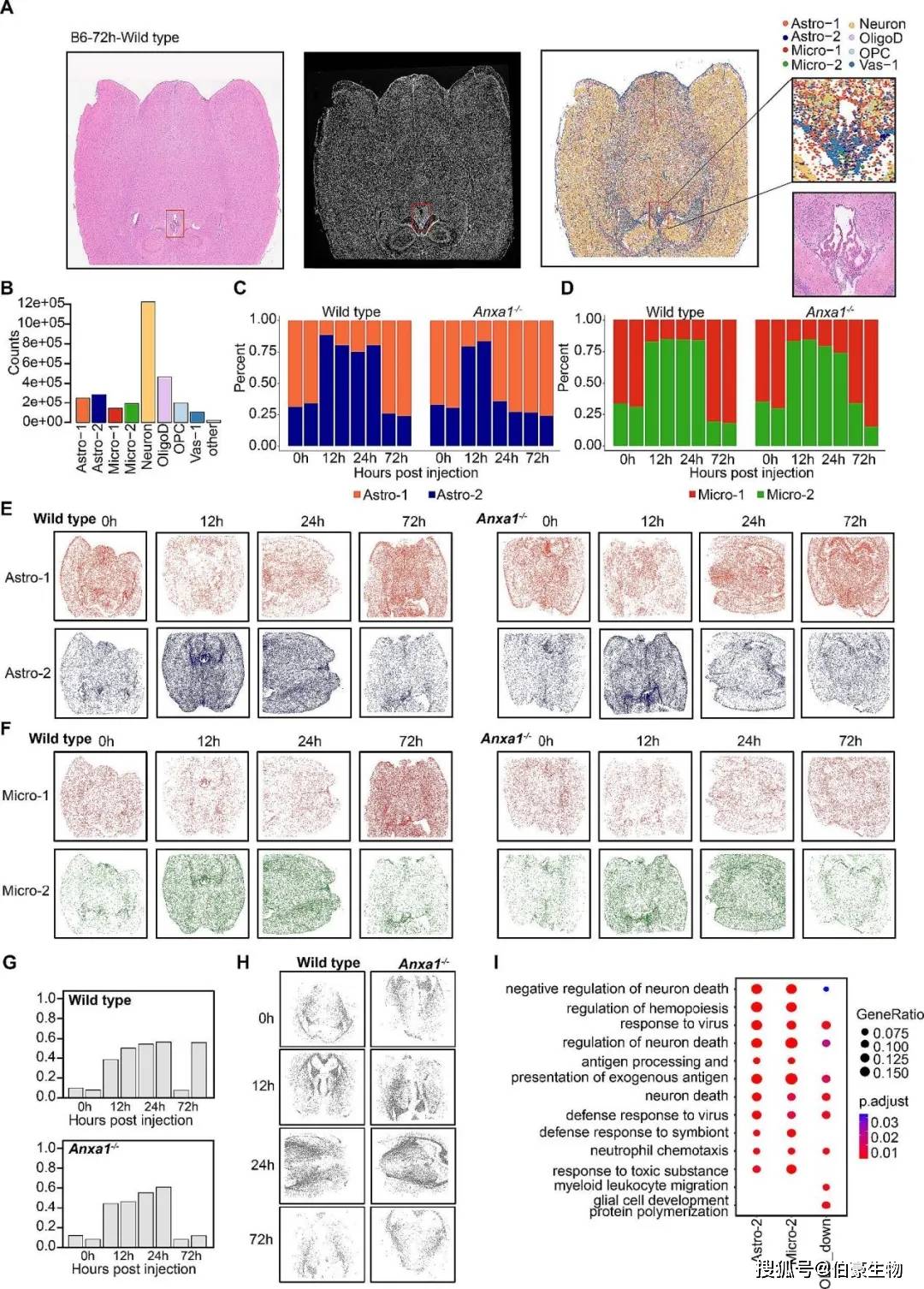 图 2 LPS刺激后小鼠大脑空间分辨转录组学分析
图 2 LPS刺激后小鼠大脑空间分辨转录组学分析
️3. 共定位分析揭示炎症相关基因模块的特异性表达及空间分布特征
某些空间转录组点中存在多种细胞类型,为了更深入地探究炎症反应的空间分布,研究人员通过空间转录组学分析,在LPS刺激后12小时和24小时上调的682个基因进行共定位分析,识别出一个包含130个基因的特异性模块,这些基因在两组中表达一致(Fig 3A)。该模块在Astro-2和Micro-2细胞群中表现出高水平的表达(Fig 3B),且主要参与“对干扰素β的响应”和“细胞因子介导的信号通路”关键的炎症途径(Fig 3C)。值得注意的是,在LPS刺激后12小时和24小时,Astro-2、Micro-2和Cdkn1a+Serpina3n+ OligoD炎症亚群显示出更高的模块得分。显著的是,Vas-1细胞簇表现出显著的上调,并在模块中显示出最高的得分,呈现出以血管为中心的分布模式(Fig 3E)。为进一步分析基因模块在Vas-1细胞点内的分布,任何超过该阈值0.5得分均表示存在130个基因的表达;最后发现该模块在包含混合Astro-2/ Micro-2/Vas-1细胞的点中显著富集(Fig 3F-H)。有趣的是,wild type小鼠在LPS刺激后12小时,血管周围的Astro-2和Micro-2细胞浓度更高(Fig 3I-J)。此外,对Astro-2、Micro-2和Vas-1细胞类型中上调基因差异基因进行GO富集分析,发现这些基因与“病毒反应”和“对生物刺激的反应”有显著关联,表明它们在炎症反应中具有重要作用(Fig 3K-L)。
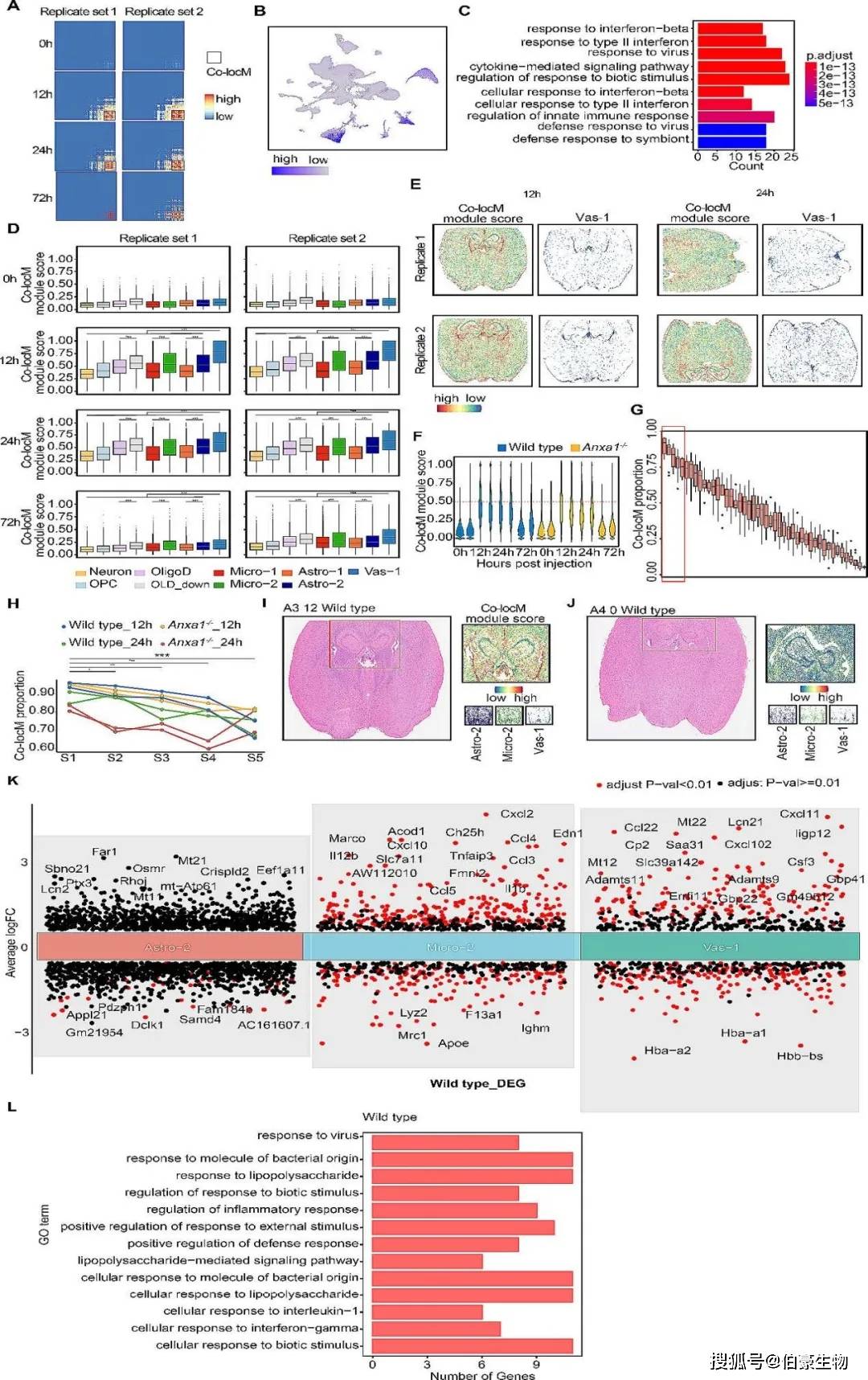 图 3 细胞的多样性和空间分布
图 3 细胞的多样性和空间分布
️4. 细胞间通讯分析揭示关键基因在炎症反应中的作用
为深入了解细胞间的相互作用,进行细胞间的通讯分析,发现LPS刺激后12小时和24小时,有11对在配体-受体基因在两组中均被激活;Timp1、Ackr1和Csf1r等基因在特定细胞类型中表现出不同的表达模式,如Timp1在Astro-2和Vas-1细胞中高表达,而其受体在多种细胞类型中广泛表达,表明Astro-2和Vas-1细胞之间可能存在调控相互作(Fig 4A)。空间共表达分析显示,在LPS刺激后12小时和24小时,两组的Col4a1-Cd93和Pdgfa-Pdgfra等基因共表达模式相似,但在24小时后,Anxa1−/−小鼠中某些基因对的共表达减弱,并通过是公共数据进行验证(Fig 4B-C)。对上调基因进行GO富集分析,揭示了它们参与免疫细胞迁移途径(Fig 4D)。进一步研究发现,Timp1和Ackr1等枢纽基因在Astro-2、Micro-2和Vas-1(统称为V1A2M2)细胞簇内表达水平较高,表明这些细胞类型之间的相互作用可能通过这些基因实现(Fig 4E)。此外,为探索枢纽基因Timp1及其相关受体在V1A2M2区域中的潜在作用,对Vas-1和表达Timp1的Astro-2细胞中存在的上调基因进行了GO分析,分析显示,在snRNA-seq和Stereo-seq数据集中,与伤口愈合和细胞迁移相关途径显著富集,表明它们可能在炎症修复过程中发挥关键作用,并可能通过Timp1介导的信号传导促进Micro-2细胞向Vas-1的迁移(Fig 4F-G)。
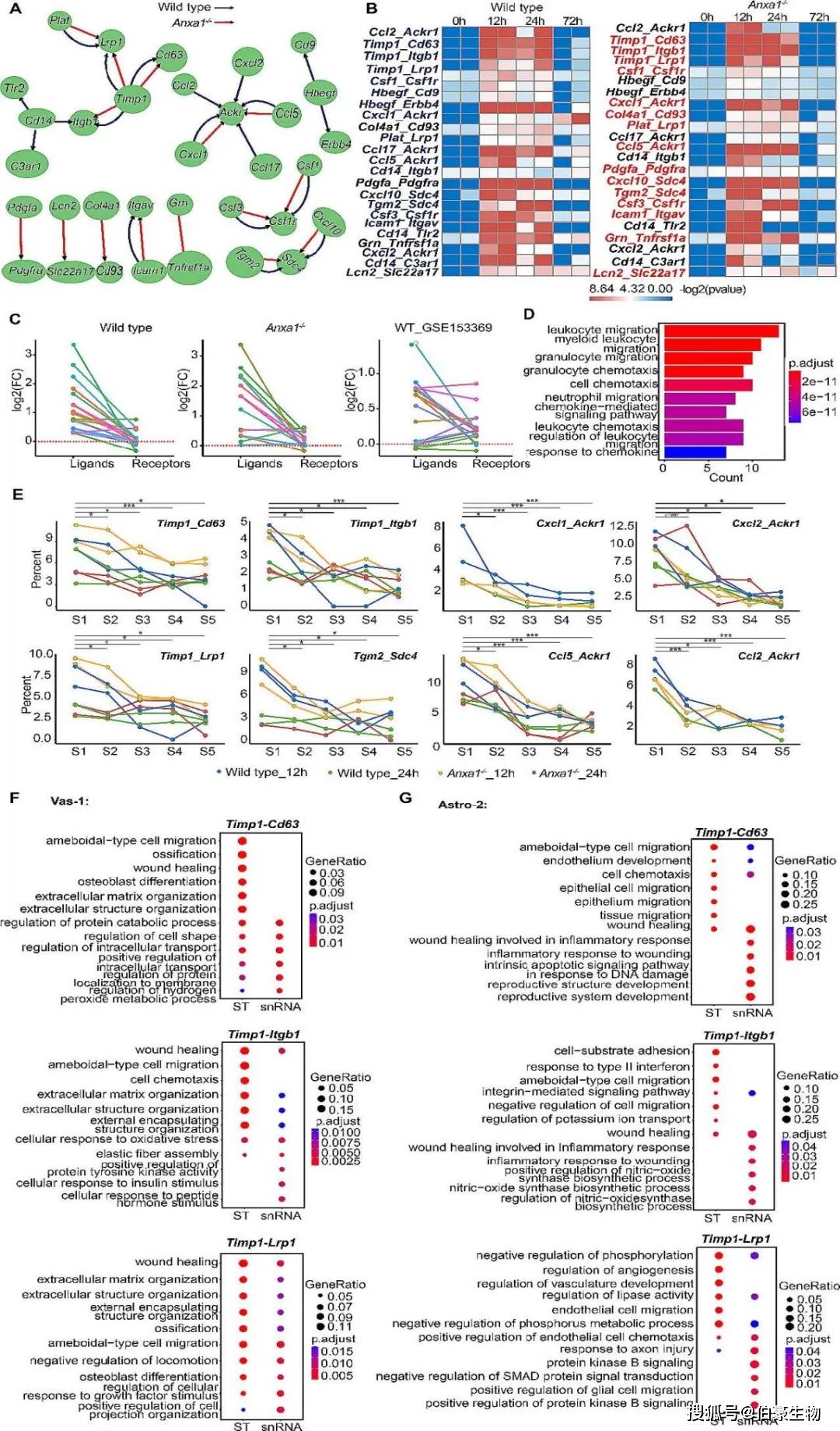 图 4 病理微结构中胶质细胞与血管成分的相互作用
图 4 病理微结构中胶质细胞与血管成分的相互作用
️5. Anxa1缺失加速V1A2M2结构衰减及其对炎症反应和存活率的影响
在LPS刺激后12小时和24小时,两组小鼠大脑的Timp1和Ackr1等基因在V1A2M2结构中表现出上调;但Anxa1的缺失导致V1A2M2保护性结构在反应阶段更快地衰减,这可能会导致存活率降低。为了阐明Anxa1的重要性,进行生存分析,结果表明Anxa1−/−小鼠的存活率明显较低,这突出了Anxa1在LPS诱导的脓毒症背景下的保护作用(Fig 5A)。通过比较两种小鼠大脑组织中Astro-2与Astro-1的比例,发现刺激后12小时,Astro-2的比例显著增加;然而,在刺激后24小时,Anxa1−/−小鼠的Astro-2水平降低;同样,在Micro-2与Micro-1细胞的比例变化也观察到了类似的趋势,表明与Anxa1的敲除相关(Fig 5B-C)。使用snRNA-seq和Stereo-seq可视化方法证实,Anxa1−/−小鼠在刺激后24小时Astro-2的下降更为显著,从而确立了与Anxa1基因敲除的直接相关性(图5D和E)。对两组小鼠大脑组织中一个包含130个基因的模块(V1A2M2)的时间表达模式进行分析发现,到24小时时,Anxa1−/−小鼠的基因下调程度比野生型小鼠更为显著(图5F)。空间转录组可视化进一步证实了这些发现(Fig 5G)。此外,在LPS刺激后24小时,Anxa1−/−小鼠中某些配体-受体配对基因的表达水平显著降低,这可能归因于特殊病理微环境V1A2M2数量的减少(Fig 5H)。进一步分析与这些基因相关的细胞百分比,发现Anxa1−/−小鼠中表达Cd14及其受体的Micro-2细胞比例,以及表达Cxcl10-Sdc4的Astro-2和Micro-2细胞比例均显著降低,表达Ccl2-Ackr1的Astro-2/Micro-2/Vas-1细胞比例也显著下降。这表明Anxa1的敲除影响了这些基因的表达,导致V1A2M2结构比例减少(Fig 5I-K)。
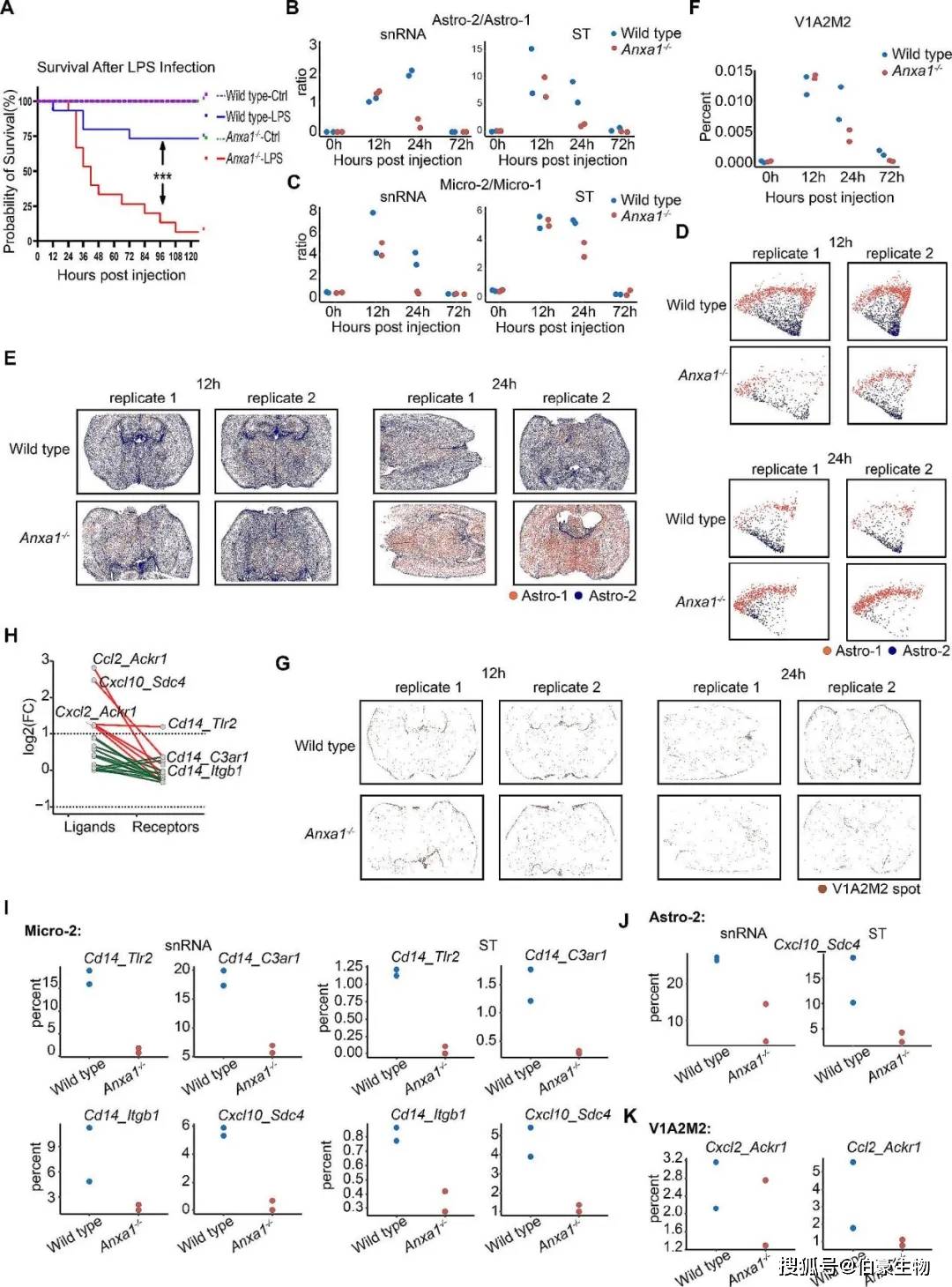 图 5 Anxa 1在病理微结构形成发病机制中的作用
图 5 Anxa 1在病理微结构形成发病机制中的作用
️结语
通过单核RNA测序和空间转录组技术,深入分析LPS诱导的脓毒症小鼠模型大脑中的细胞和分子变化。研究发现,在LPS刺激后12小时和24小时,Anxa1−/−小鼠和wild type小鼠均显示出Astro-2和Micro-2细胞比例的显著增加,这些细胞与Vas-1细胞共同形成独特的V1A2M2病理微环境。然而,与wild type小鼠相比,Anxa1−/−小鼠在24小时时V1A2M2区域的Astro-2和Micro-2细胞比例和分布显著减少,且相关配体-受体对的表达水平降低。此外,Anxa1−/−小鼠的存活率低于野生型小鼠,表明Anxa1在SAE中具有保护作用。研究还发现,Anxa1的敲除影响了Cd14、Cxcl10-Sdc4和Ccl2-Ackr1的表达,导致V1A2M2结构比例减少。这些结果揭示了Anxa1在调节神经炎症反应和维持脑部病理微环境中的重要作用,为理解SAE的发病机制提供了新的视角。
️参考文献:
Zhu Y, Zhang Y, He S, et al. Integrating single-nucleus RNA sequencing and spatial transcriptomics to elucidate a specialized subpopulation of astrocytes, microglia and vascular cells in brains of mouse model of lipopolysaccharide-induced sepsis-associated encephalopathy. J Neuroinflammation. 2024 Jul 3;21(1):169. doi: 10.1186/s12974-024-03161-0. PMID: 38961424; PMCID: PMC11223438.


