药物亲和响应靶标稳定性 DARTS技术的诞生
DARTS技术由Lomenick团队于2009年在《美国国家科学院院刊》(PNAS)首次报道。其理论基础源于对生物大分子相互作用的深入观察:当DNA与转录因子结合,或蛋白质与天然配体(如糖类、核酸)相互作用时,其结构稳定性显著增强,表现为对核酸酶或蛋白酶的水解抗性大幅提高。基于这一现象,研究者提出了一个创新性假说:小分子药物与靶蛋白结合后,可能会增强靶蛋白对蛋白酶解的耐受性。
为验证这一假设,研究团队在重组蛋白体系中进行了系统实验。他们以经典的药靶对FKBP12及其抑制剂雷帕霉素/FK506作为模型,发现经药物处理的FKBP12对枯草杆菌蛋白酶的敏感性显著降低(EC50下降约5倍),而无关药物则无此效应。进一步在结合力较弱的E4-mTOR系统中重复实验,仍观察到显著的水解保护现象,从而初步证实了该方法的普适性。
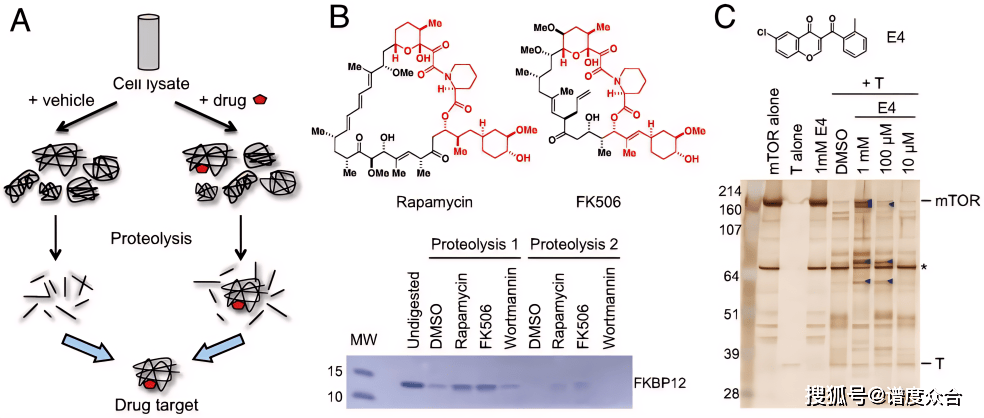 Figure 1 DARTS技术原理示意图A、DARTS技术概念图B、重组人FKBP12蛋白与指定的药物共同孵育后,经枯
Figure 1 DARTS技术原理示意图A、DARTS技术概念图B、重组人FKBP12蛋白与指定的药物共同孵育后,经枯
Figure 1 DARTS技术原理示意图A、DARTS技术概念图B、重组人FKBP12蛋白与指定的药物共同孵育后,经枯草蛋白酶消化的原理验证C、mTOR激酶抑制剂E4的DARTS实验
在复杂生物体系验证中,研究采用了靶向EF-1α的天然产物didemnin B处理Jurkat细胞。通过SDS-PAGE分析,药物处理组在50 kDa区域出现了明显的保护条带,质谱鉴定确认为EF-1α蛋白。进一步的免疫印迹实验表明,EF-1α的酶解保护效应呈现药物浓度依赖性,为DARTS技术的可行性提供了直接证据。
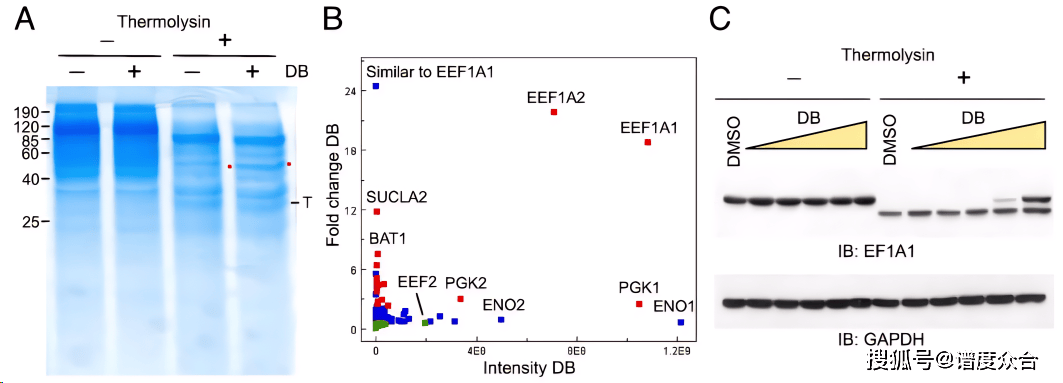
Figure 2 全细胞裂解液DARTS实验A、完整的Jurkat细胞用DB(1 g/ml)处理,并对裂解液进行嗜热菌蛋白酶消化和考马斯亮蓝染色B、通过质谱分析揭示保护条带中的EF-1蛋白C、通过免疫印迹检测DARTS
基于这些基础研究,研究团队通过多组药靶对验证了该技术的通用性,并成功实现了对药物白藜芦醇分子靶标的筛选。DARTS技术因其操作简便、无需化学修饰等优势,迅速成为药物靶点筛选的重要工具,至今仍被广泛应用于靶标发现研究。


